Nature子刊:傅阳心/彭华团队开发双功能抗癌融合蛋白,在清除Treg的同时激活CD8+T细胞
来源:生物世界 2024-12-05 10:43
通过以上设计构建的融合蛋白在小鼠体内展示出清除Treg,同时激活CD8+T的双功能特性。相比于单独的细胞因子,融合蛋白展示出良好的安全性和有效性,为下一代融合蛋白药物提供了全新的设计思路。
清华大学傅阳心教授团队和中国科学院生物物理研究所彭华研究员(现为广州国家实验室研究员)团队在 Nature Biomedical Engineering 期刊发表了题为:Concurrent intratumoural Treg cell depletion and CD8+ T cell expansion via a cleavable anti-4-1BB–interleukin-15 fusion protein 的研究论文。
该研究通过构建anti-4-1BB抗体和IL-15-IL-15Rα(Super IL-15)的融合蛋白,实现对肿瘤浸润的Treg细胞特异性地清除以及对CD8+T细胞的激活,在有效增强抗肿瘤免疫反应的同时避免IL-15-IL15Rα引起的副作用。

该研究的设计理念包括:
1. 精准靶向:选择合适的靶向肿瘤内Treg的靶点,利用Fc介导的ADCC/ADCP(抗体依赖的细胞介导的杀伤作用/抗体依赖的细胞介导的吞噬作用)功能对Treg进行杀伤。
2. 补给选择:选择合适的针对CD8+T的细胞因子,避免对Treg的活化。
3. 补给投送:做到肿瘤内精准投送,避免补给在投送过程中被损坏。
4. 补给保护:靶向过程中避免细胞因子被损耗,确保有足够量的补给到达战场。
按照以上思路,该团队对融合蛋白进行巧妙设计:
1. 选择4-1BB作为肿瘤内Treg的靶点,表达高,特异性强。
2. 使用具有完整功能的Fc介导杀伤。
3. 选择IL-15-IL-15Rα来激活T细胞,避免IL-2对Treg的激活。
4. 因IL-15与受体(IL-2Rβ/γ)结合的部分关键位点位于IL-15的N端,通过缩短Fc与IL-15之间的距离,利用Fc的蛋白结构阻断IL-15与受体的结合;同时为了避免在杀伤过程中细胞因子被内吞,在Fc与IL-15之间使用了能够被肿瘤内高表达的基质金属蛋白酶有效切割的linker多肽,实现融合蛋白到达肿瘤后高效释放IL-15-IL-15Rα。
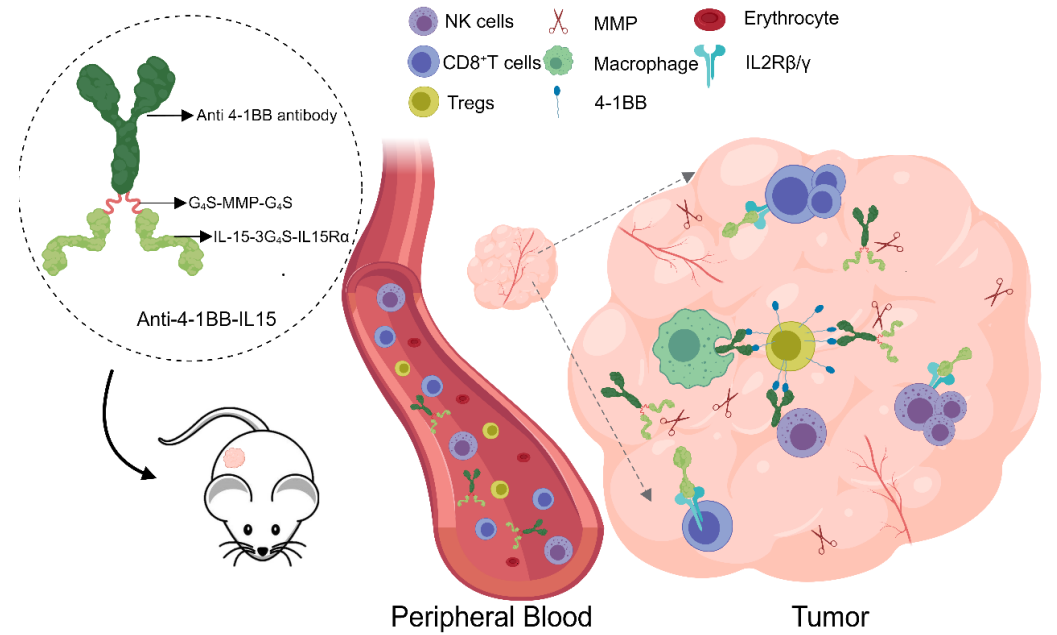
通过以上设计构建的融合蛋白在小鼠体内展示出清除Treg,同时激活CD8+T的双功能特性。相比于单独的细胞因子,融合蛋白展示出良好的安全性和有效性,为下一代融合蛋白药物提供了全新的设计思路。
清华大学医学院傅阳心教授和中国科学院生物物理所彭华研究员(现广州国家实验室研究员)为论文共同通讯作者。清华大学基础医学院博士后蔡月淇和清华大学基础医学院博士研究生韩子龙为论文共同第一作者。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


